प्रथम ऊष्मागतिकी नियम के अनुसार, किसी विलगित निकाय (isolated system) के लिए निम्नलिखित में से कौन सा कथन सत्य है?
Answer: आंतरिक ऊर्जा में परिवर्तन शून्य होता है।
ऊष्मागतिकी, भौतिकी की वह शाखा है जो ऊष्मा, कार्य, तापमान और ऊर्जा के अन्य रूपों के बीच संबंधों का अध्ययन करती है। यह प्रकृति के मौलिक नियमों में से एक है और रासायनिक अभिक्रियाओं, इंजीनियरिंग प्रक्रियाओं और यहां तक कि जैविक प्रणालियों को समझने के लिए महत्वपूर्ण है। ऊष्मागतिकी के तीन मुख्य नियम हैं, जिनमें से प्रत्येक ऊर्जा के व्यवहार के बारे में एक महत्वपूर्ण अंतर्दृष्टि प्रदान करता है। इन नियमों ने हमारे ब्रह्मांड को देखने और हेरफेर करने के तरीके को गहराई से प्रभावित किया है।
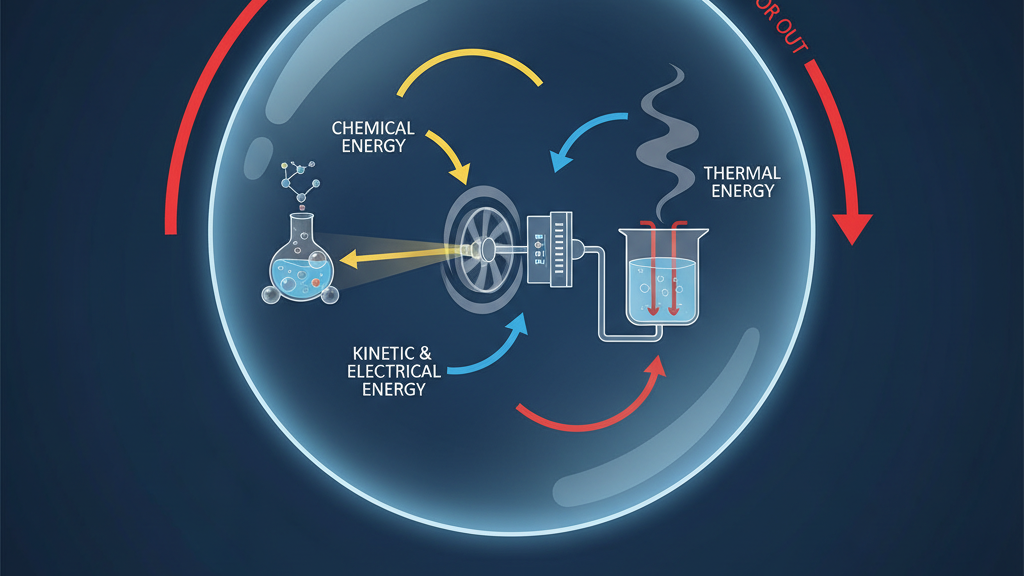
प्रथम ऊष्मागतिकी नियम, जिसे ऊर्जा संरक्षण के नियम के रूप में भी जाना जाता है, बताता है कि ऊर्जा को न तो बनाया जा सकता है और न ही नष्ट किया जा सकता है; इसे केवल एक रूप से दूसरे रूप में परिवर्तित किया जा सकता है। गणितीय रूप से, इसे अक्सर ΔU = Q - W के रूप में व्यक्त किया जाता है, जहाँ ΔU निकाय की आंतरिक ऊर्जा में परिवर्तन है, Q निकाय को दी गई ऊष्मा है, और W निकाय द्वारा किया गया कार्य है। यह नियम बताता है कि किसी भी प्रक्रिया में, ऊर्जा का कुल योग स्थिर रहता है। उदाहरण के लिए, जब आप किसी धातु के टुकड़े को गर्म करते हैं, तो आप उसे ऊष्मा (Q) प्रदान करते हैं। यह ऊष्मा धातु की आंतरिक ऊर्जा (ΔU) को बढ़ाती है और संभवतः उसे थोड़ा विस्तारित भी कर सकती है, जिससे कार्य (W) होता है। कुल ऊर्जा, हालांकि, संरक्षित रहती है।
अब, आइए विशेष रूप से "विलगित निकाय" (isolated system) की अवधारणा पर ध्यान केंद्रित करें। एक विलगित निकाय एक ऐसा निकाय है जो अपने परिवेश के साथ न तो ऊर्जा का आदान-प्रदान करता है और न ही पदार्थ का। इसका मतलब है कि निकाय के अंदर ऊष्मा स्थानांतरित नहीं हो सकती है, और न ही निकाय बाहर से कोई कार्य प्राप्त कर सकता है या बाहर कोई कार्य कर सकता है। इस आदर्श स्थिति में, प्रथम ऊष्मागतिकी नियम का समीकरण ΔU = Q - W सरलीकृत हो जाता है। चूँकि विलगित निकाय अपने परिवेश से ऊर्जा का आदान-प्रदान नहीं कर सकता है, निकाय को दी गई ऊष्मा (Q) शून्य होती है। इसी तरह, चूँकि वह अपने परिवेश के साथ कोई कार्य नहीं करता है या उससे कार्य प्राप्त नहीं करता है, निकाय द्वारा किया गया कार्य (W) भी शून्य होता है।
इसलिए, प्रथम ऊष्मागतिकी नियम के अनुप्रयोग में, एक विलगित निकाय के लिए, ΔU = 0 - 0, जिसका अर्थ है ΔU = 0। यह दर्शाता है कि एक विलगित निकाय की आंतरिक ऊर्जा स्थिर रहती है; यह न तो बढ़ती है और न ही घटती है। आंतरिक ऊर्जा, एक निकाय के भीतर कणों की कुल ऊर्जा का प्रतिनिधित्व करती है, जिसमें उनकी गतिज और स्थितिज ऊर्जा शामिल है। चूँकि कोई ऊर्जा प्रवेश या निकास नहीं हो रहा है, यह समग्र ऊर्जा अपरिवर्तित रहती है। यह एक महत्वपूर्ण अवधारणा है जो कई भौतिक और रासायनिक प्रणालियों के व्यवहार की भविष्यवाणी करने में मदद करती है।
हालांकि पूर्ण रूप से विलगित निकाय प्रकृति में दुर्लभ हो सकते हैं, यह अवधारणा कई सैद्धांतिक गणनाओं और आदर्श मॉडलों के लिए एक मूल्यवान उपकरण है। उदाहरण के लिए, एक पूरी तरह से इंसुलेटेड कंटेनर के भीतर एक रासायनिक प्रतिक्रिया पर विचार करें, जहाँ बाहरी वातावरण के साथ कोई ऊष्मा या पदार्थ का आदान-प्रदान नहीं होता है। ऐसी स्थिति में, प्रतिक्रिया में शामिल अभिकारकों और उत्पादों की कुल आंतरिक ऊर्जा अपरिवर्तित रहेगी। यह सिद्धांत हमें यह समझने में मदद करता है कि ऊर्जा को नियंत्रित और परिवर्तित किया जा सकता है, लेकिन कुल मात्रा हमेशा समान रहती है।
प्रथम नियम का एक और महत्वपूर्ण पहलू यह है कि यह ऊष्मा के प्रवाह की दिशा को निर्धारित नहीं करता है। यह केवल यह बताता है कि ऊर्जा कैसे संरक्षित है। उदाहरण के लिए, यह बता सकता है कि किसी गर्म वस्तु से ठंडी वस्तु में ऊष्मा स्थानांतरित हो सकती है, लेकिन यह यह नहीं बताता कि यह हमेशा गर्म से ठंडे की ओर ही क्यों प्रवाहित होती है। इस दिशात्मकता की व्याख्या द्वितीय ऊष्मागतिकी नियम द्वारा की जाती है, जो एन्ट्रापी (entropy) की अवधारणा को प्रस्तुत करता है।
ऊष्मागतिकी के अन्य नियमों के साथ प्रथम नियम का संयोजन हमें विभिन्न प्रणालियों के व्यवहार की भविष्यवाणी करने की अनुमति देता है। उदाहरण के लिए, इंजन कैसे काम करते हैं, रेफ्रिजरेटर कैसे ठंडक पैदा करते हैं, और रासायनिक अभिक्रियाएं कितनी ऊर्जा जारी करेंगी, यह सभी ऊष्मागतिकी के सिद्धांतों पर आधारित हैं। विशेष रूप से, प्रथम नियम यह सुनिश्चित करता है कि कोई भी मशीन 100% कुशल नहीं हो सकती क्योंकि कुछ ऊर्जा हमेशा ऊष्मा के रूप में खो जाती है, जिसे उपयोगी कार्य में परिवर्तित नहीं किया जा सकता है।
संक्षेप में, प्रथम ऊष्मागतिकी नियम ऊर्जा संरक्षण का एक मूलभूत सिद्धांत है। एक विलगित निकाय के संदर्भ में, इस नियम का सबसे प्रत्यक्ष निहितार्थ यह है कि निकाय की आंतरिक ऊर्जा स्थिर रहती है क्योंकि यह अपने परिवेश के साथ ऊष्मा या कार्य का आदान-प्रदान नहीं कर सकता। इस नियम ने विज्ञान और प्रौद्योगिकी के कई क्षेत्रों में क्रांति ला दी है, जिससे हमें ऊर्जा के उपयोग को बेहतर ढंग से समझने और प्रबंधित करने में मदद मिली है। क्या आप सोच सकते हैं कि प्रकृति के अन्य किन नियमों में इसी तरह की सार्वभौमिक संरक्षण की अवधारणाएं निहित हैं?